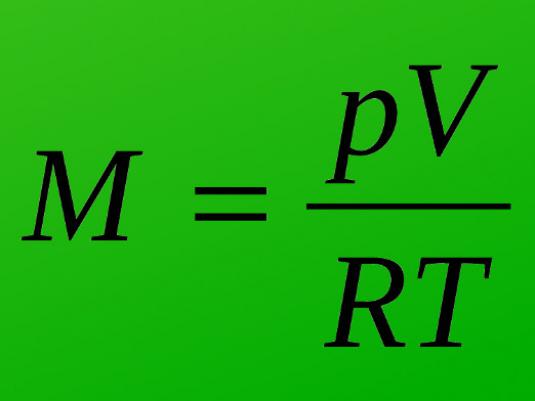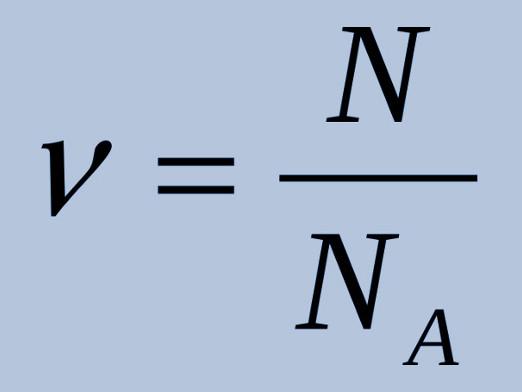Hvordan finne massen av materie?

I kjemi kan ikke uten mange stoffer. Tross alt er dette en av de viktigste parameterne for et kjemisk element. Vi vil fortelle deg hvordan du finner massen av materie på ulike måter i denne artikkelen.
Først og fremst må du finne den retteelement, ved hjelp av det periodiske tabellen, som du kan laste ned på nettet eller kjøpe. Brøk tall under elementet tegnet er dens atommasse. Det må multipliseres med indeksen. Indeksen viser hvor mange molekyler av elementet som finnes i en gitt substans.
- Når du har en kompleks substans, trenger dumultiplisere atommassen til hvert element av materie ved sin indeks. Nå er det nødvendig å legge til atommassene mottatt av deg. En slik masse måles i enheter gram / mol (g / mol). Hvordan finne en masses molare masse, viser vi på eksemplet for beregning av molekylvekten av svovelsyre og vann:
H2SO4 = (H) * 2 + (S) + (O) * 4 = 1 * 2 + 32 + 16 * 4 = 98 g / mol;
H20 = (H) * 2 + (0) = 1 * 2 + 16 = 18 g / mol.
Molarmassen av enkle stoffer, som består av et enkelt element, beregnes på samme måte.
- Du kan beregne molekylvekten i henhold til eksisterende molekylvektstabell, som kan lastes ned på Internett eller kjøpes fra bokhandel
- Du kan beregne molarmassen ved å bruke formler og likestille den til molekylmassen. Måleenhetene må endres fra "g / mol" til "amu".
Når du for eksempel kjenner volumet, trykket,og masse Kelvin temperaturskala (C dersom det er nødvendig for å oversette), lære å finne de molekylære stoffer kan, ved hjelp av ligningen Mendeleyev-Clapeyron:
M = (m * R * T) / (P * V),
hvor R er universell gass konstant; M er molekylær (molar masse), amu.
- Molarmassen kan beregnes ved å bruke formelen:
M = m / n,
hvor n er mengden av stoffet; m er stoffets masse. Her er det nødvendig å uttrykke mengden materie etter volum (n = V / VM) eller Avogadros tall (n = N / NA).
- Hvis verdien av gassvolumet er gitt, så finn detmolekylmassen kan tas av forseglet ballong med et kjent volum og evakuere luften. Nå må du veie ballongen på skalaene. Deretter helles gass inn i den og veier igjen. Forskjellen mellom massene av en tom sylinder og en gassflaske er massen av gassen vi trenger.
- Når du trenger å utføre prosessen med kryoskopi, må du beregne molekylvekten med formelen:
M = P1 * Ek * (1000 / P2 * Δtk),
hvor P1 er massen av løsemiddelet, g; P2er massen av løsningsmidlet, g; Ek er en kryoskopisk løsningsmiddelkonstant som kan bestemmes ut fra det tilsvarende tabellen. Denne konstanten er forskjellig for forskjellige væsker; Δtk er temperaturforskjellen, som måles med et termometer.
Nå vet du hvordan du finner en masse materie, enten enkelt eller komplisert, i en hvilken som helst samlet tilstand.