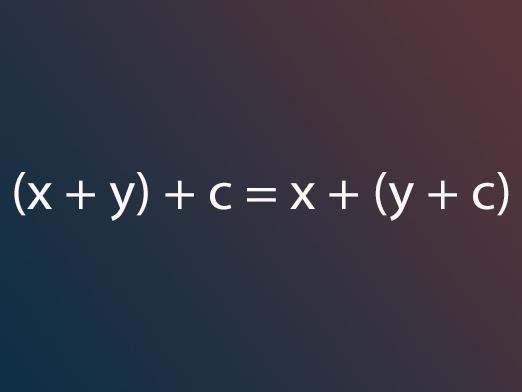Hva er de viktigste egenskapene til oksider?
Fra skolen kjemi programmet til hver av ossDet er sikkert kjent at oksyder er ganske komplekse kjemiske stoffer, som er forbindelser av ganske enkle elementer med en gass som oksygen. Det er saltdannende oksider og oksider som ikke danner salt. De førstnevnte er videre delt inn i tre kategorier: sur, grunnleggende og amfotere. La oss se på de kjemiske egenskapene til oksider.
Grunnleggende oksider
Til denne typen oksider er kompleksekjemikalier som er i stand til å danne salter når de omsettes med syrer eller oksyder, men reagerer ikke og basiske oksyder eller baser. For eksempel er følgende hovedoksider: kaliumoksid, kalsiumoksyd, jernholdig oksid.
La oss nå ta et eksempel på egenskapene til det grunnleggende oksydet.
1. Reaksjon med vann. Angi samspillet i H2Å, det grunnleggende oksydet danner alkali. For eksempel reaksjonen av quenching kalk. CaO + H2O = Ca (OH)2.
2. Reaksjon med syrer. Ved omsetning med syrer dannes vann og salter, for eksempel CaO + H2SO4 = CaSO4+ H2O.
3. Reaksjon med sure oksider. Ved interaksjon med syreoksider dannes salt. For eksempel, CaO + CO2= CaCO3 - utdanning formel Jeg kritt.
Sure oksider
Dette er den såkalte komplekse kjemikalienstoffer som refererer til oksider og interagerer med basiske oksider eller baser, danner salter. Et eksempel er karbondioksid CO2, svoveltrioksid SO3. Egenskapene til oksydene er som følger:
-acidoksyder kan reagere med vann. For eksempel er det på denne måten at karbonsyre CO2+ H2O = H2CO3 .
- med alkalier eller baser. Et eksempel er følgende CO2+ NaOH = Na2CO3. Som et resultat, bør det ikke være noe annet ennkalsinert eller vaskesoda. Det er et utmerket middel for å fjerne smuss og fett fra overflaten av panner. Også ved hjelp av dette verktøyet fjerner enkelte landladier brente områder.
- Reaksjon med basiske oksyder. Eksempel - CO2+ MgO = MgCO3, produksjon av magnesiumkarbonat.
Amfotere oksider
Slike oksider kalles kompleks kjemiskstoffer som også kan tilskrives oksider som ikke danner noe mer enn salter i prosessen med kjemisk reaksjon med syrer eller baser. Ofte er vi vant til å bruke ordet "amfotere" når vi snakker om metaller. Dette er delvis korrekt, fordi i dette tilfellet kalles oksider amfotere, fordi de reagerer med metaller.
Som et eksempel på et amfotert oksid, sinkoksyd ZnO, som er mye brukt i medisin eller aluminiumoksid Al2O3.
Hovedegenskapene til oksider som reagerer med metaller er at de er i stand til å reagere ikke bare med syrer, men også med baser.
Et eksempel er samspillet mellom et amfotert oksid og et oksygenoksyd, noe som resulterer i ZnO + H2CO3 = ZnCO3 + H2O.
På samme måte oppnås også et dobbelt salt av sink og natrium. Slike reaksjoner oppstår vanligvis med økt energiutslipp.
For å forstå hva denne eller den reaksjonen ser ut, er det ikke nok en beskrivelse, det er nødvendig å gjøre det selv i laboratoriet.